导语:乳腺癌是全球女性中最常见的恶性肿瘤之一,5年生存率约为70%-90%。曲妥珠单抗的问世改变了HER2阳性乳腺癌的预后,但仍有约25%的HER2阳性早期乳腺癌患者会出现复发,据研究显示,78%的HER2阳性晚期乳腺癌是由于早期乳腺复发所致。因此,“治愈”成为了早期乳腺癌治疗所追求的“主旋律”,而在围术期就更早地给予有效治疗方案将大大增加患者治愈机会。帕妥珠单抗上市一周年,与曲妥珠单抗双靶联用为HER2阳性早期乳腺癌患者治疗提供了良好解决方案。
2020年6月6日,以“愈她·源自预见”为主题的“中国乳腺癌精准诊疗云峰会”成功举办。众多乳腺癌领域专家学者,共话乳腺癌精准诊疗。会议期间,由复旦大学附属肿瘤医院李俊杰教授带来的《HER2阳性早期乳腺癌多临床决策点之新辅助治疗的优化》主题汇报备受关注。找到新辅助治疗决策点,重点关注三个方面:新辅助治疗人群选择、初选及优选方案、根据新辅疗效决定后续治疗策略,以及如何在临床实践中的每一步优化治疗策略,值得考量。(本文素材摘录自李俊杰教授大会演讲内容)
根据治疗目标,有一定肿瘤负荷/“降阶梯”手术需求的HER2+患者,优选新辅助治疗
对于TNBC和HER2+的患者,肿块大于2cm、淋巴结阳性,可选择行新辅助治疗。但对其中肿瘤负荷相对较小的HER2+患者优选新辅助治疗,不仅为了降期手术、降期保乳、降期保腋窝,还可以通过疗效决定全程治疗策略。这个过程需要多学科团队协作,需要影像和病理,帮助外科医生去评估肿瘤退缩模式,才能更好地判断疗效,决定后续治疗策略。
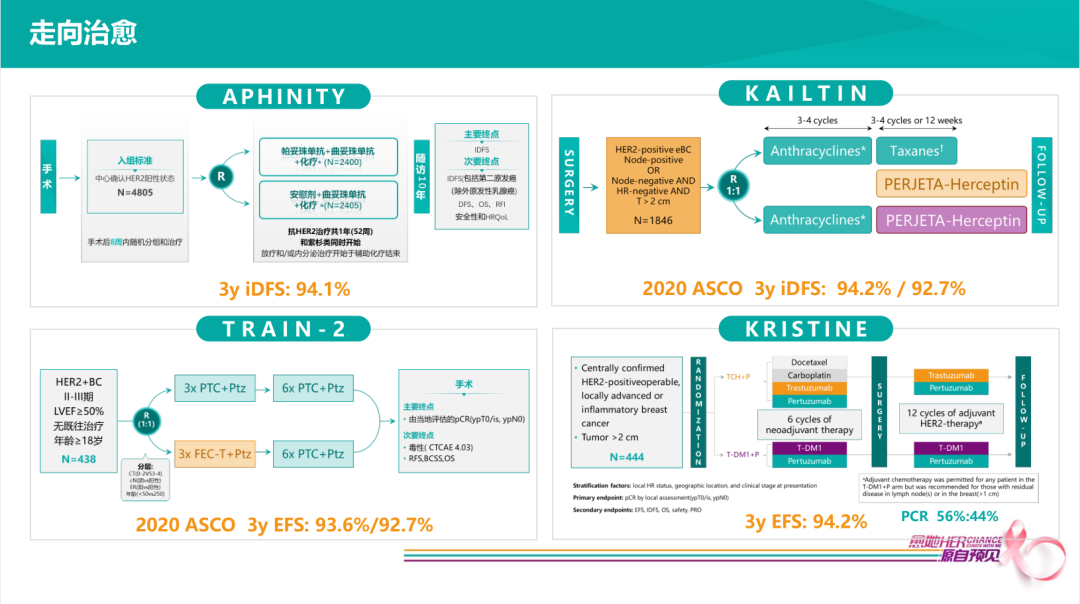
当有了新的靶向药物治疗选择时,患者治疗策略得到进一步改善。
APHINITY研究:所有HER2+患者,手术后再行双靶治疗,研究组三年iDFS达94.1%。
TRAIN-2研究(2020 ASCO):所有HER2+患者接受9个疗程双靶新辅助治疗,随后再接受为期半年的曲妥珠单抗单药治疗,三年EFS达93.6%。
KAILTIN研究(2020 ASCO):辅助阶段采用双靶治疗组,2020年ASCO公布三年iDFS达94.2%。
KRISTINE研究:从新辅助到辅助,全程采用双靶治疗组,三年EFS达94.2%。
以上循证医学证据提示,在新辅助/辅助治疗全程双靶联合化疗,HER2+早期乳腺癌患者3年iDFS稳定在94%。当选择这些靶向治疗新药物作为治疗策略的时候,我们的患者治疗结果已经得到很大的改善。我们可以看到不管是新辅助还是辅助去使用,只要用到了这些好的治疗策略,我们就能让94%的HER2阳性早期乳腺癌患者3年内免于复发。所以这样的情况下是否每一个HER2阳性的患者,都有必要去优选新辅助治疗呢?
是否每一个HER2+患者,都有必要优选新辅助治疗?
通常对于辅助复发风险高的患者,选择升阶梯治疗。但对于个体患者,通过行新辅助治疗,疗效好的患者选择降阶梯,疗效不佳的患者选择升阶梯。新辅助作为一种治疗决策,似乎拥有预测价值。但在临床实践中,对于个体患者,仍需根据疾病复发风险来决定后续治疗策略。
对于T0N0的患者,没有必要采用双靶的新辅助治疗来观察疗效决定后续治疗策略,APT研究提示,单靶加紫杉仍可控制非常好的治疗效果。对于T2N2的患者,优选新辅助治疗,因为部分肿瘤负荷较大的患者,辅助阶段仅仅使用双靶,仍无法获得足够好的预后,所以通过双靶进行新辅助,筛选出对双靶仍未达pCR的患者再行辅助强化治疗,以获得更好的预后。
临床分期≥T2,M0或≥N1,M0的患者,可选行新辅助治疗。
可手术(≤T3N1)患者,新辅助是可选治疗策略。
不可手术的患者,新辅助是必选治疗策略,只有通过新辅助降期之后才可获得手术机会。
当HER2+,有一定肿瘤负荷、有局部治疗需求的患者,新辅助是优选治疗策略。
临床实践中的“最强方案”:PCHP为HER2+EBC首选新辅助治疗方案
如果HER2+患者选择新辅助治疗,初选的治疗方案是什么?
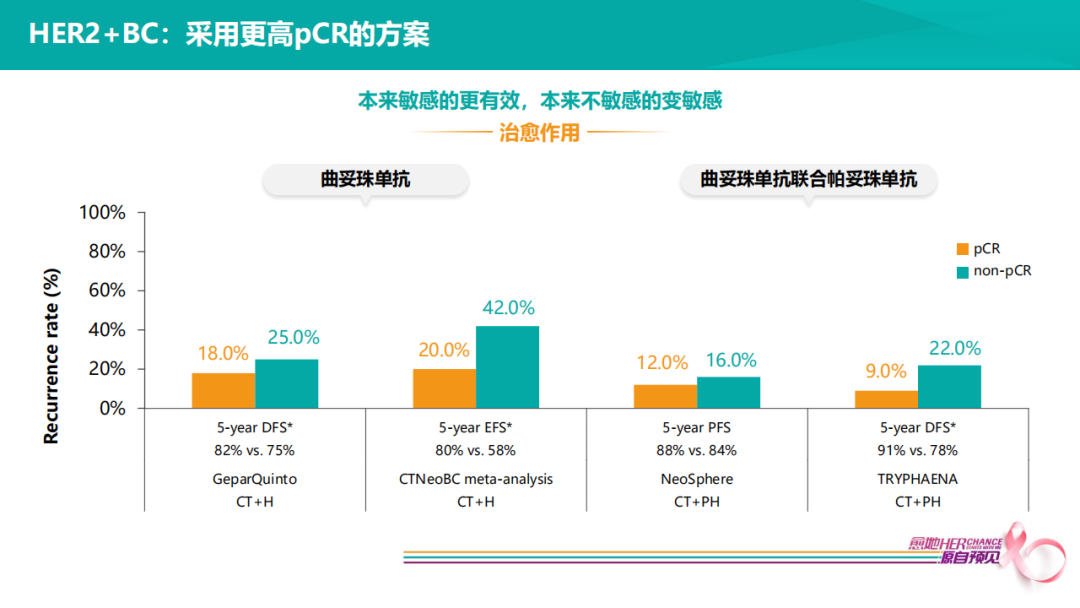
如选择单靶+化疗,即便达到pCR的患者,5年仍有20%复发率。如果选择双靶治疗,5年复发率下降至10%左右。这说明双靶治疗不但提高pCR,而且可以使pCR和non-pCR的患者预后都变得更好。
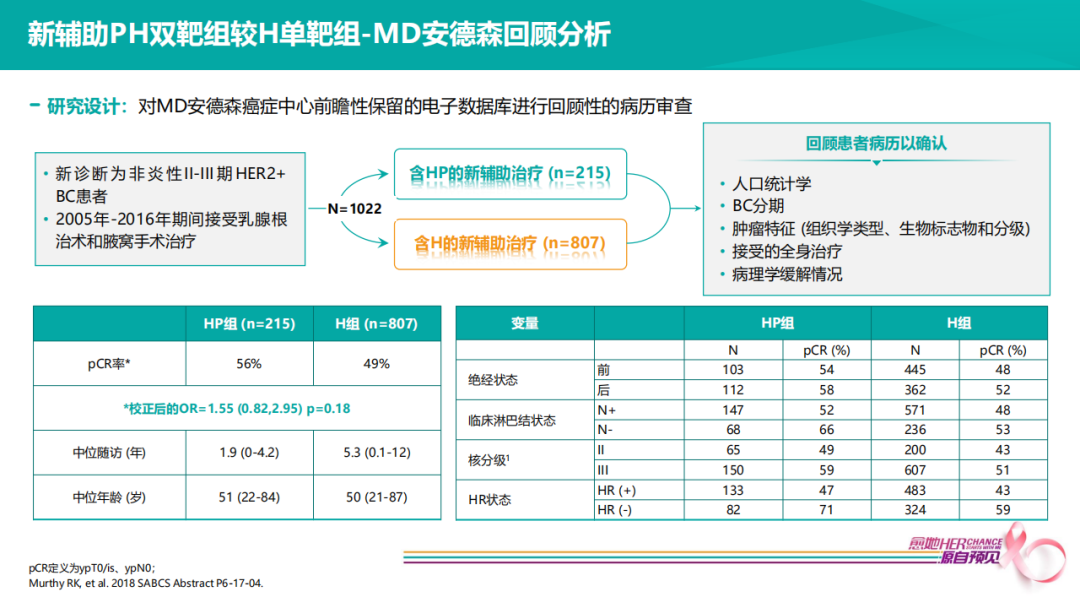
一项MD安德森单中心的回顾分析显示,新辅助PH双靶组较H单靶组-标准局部治疗和全身治疗病例(n=1022)中,含PH双靶新辅助治疗组的pCR率更高。随访3年,单靶组复发风险9%,RFS 91%,双靶组复发风险在pCR患者中只有2%,再次提示,在当前药物可及的情况下,更多专家会推荐双靶作为新辅助治疗方案。
HER2+新辅助治疗,在优选双靶的基础上,如何考量化疗配伍呢?
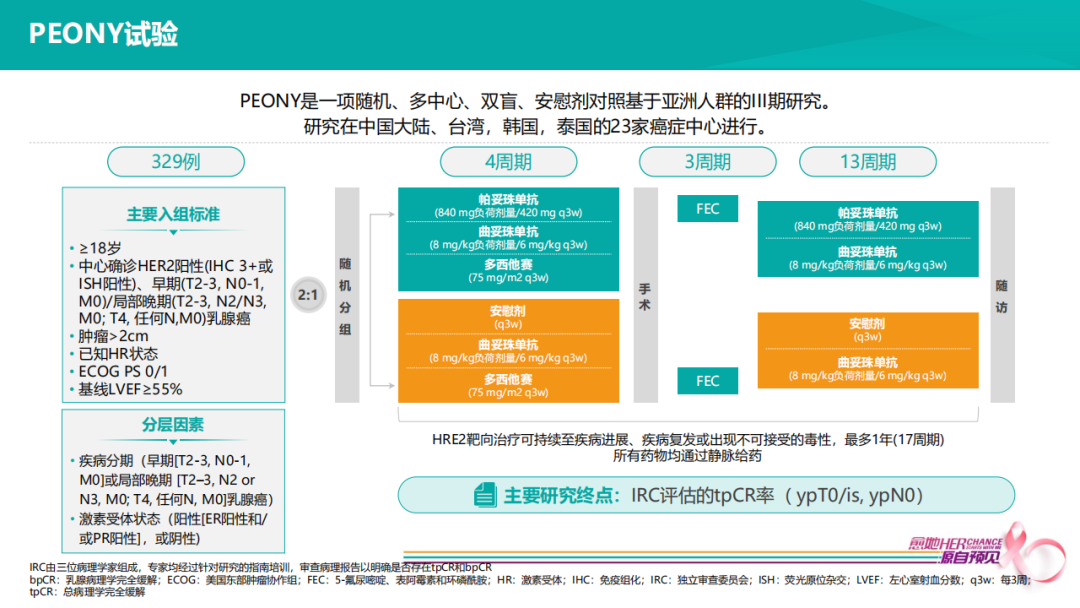
在PEONY临床试验中,入组75% N+、30% T3/T4的患者,即便肿瘤负荷较大,即便单化疗进行4个疗程双靶治疗,tpCR也能达到40%。所以很多临床专家会在实践中选择PEONY用药方案。使用过程中,逐渐出现一些疑问,4个疗程THP疗效非常好的情况,是否可以用满6个疗程,达到pCR后,是否可以不在辅助阶段补充3个疗程的FEC?又或者THP治疗2-3个疗程之后,疗效不佳的情况下,到底是单化疗不够好,还是抗HER2方案用的不够好?所以我们反复重申的是,临床研究不同于临床实践,PEONY研究目的是为证实新辅阶段双靶pCR率高于单靶,但这样的一个研究方案并不是当前临床实践中优选的治疗策略。
中国实践中,新辅治疗策略通常会选择以下4种方案:

EC-THP和THP-EC两种方案,如果在新辅阶段足疗程使用的话,最终pCR率相似,如果单用EC在前而未用抗HER2治疗,更多患者会在前4个疗程中疾病稳定甚至疾病进展。所以方案1和2相比,更推荐选择THP-EC。
但随着循证医学证据的增加,新辅阶段蒽环3-4个疗程联合使用抗HER2治疗,并未增加更多心脏毒性,保持良好耐受性。对于HER2+患者,新辅阶段最终pCR率取决于总疗程数和抗HER2疗程数。所以ECHP-THP和THP-EC比较,保障安全性基础上,更推荐选择ECHP-THP。随着TRAIN-2研究在2020年ASCO中公布的长期结果,更推荐采用紫杉醇+铂类+曲妥珠单抗+帕妥珠单抗作为HER2+初选治疗策略。
在《中国乳腺癌新辅助治疗专家共识(2019年版)》中,70%的专家认为在药物可及的情况下,HER2+患者首选新辅助策略是妥妥双靶治疗。但论及双靶的化疗配伍,几乎所有辅助可用方案在新辅助均可使用,似乎没有很好的一个优选的治疗推荐,随着TRAIN-2研究结果的公布,其实给了这个问题一部分解答。

TRAIN-2研究中,HER2+患者,研究组中化疗使用9个疗程紫杉+铂类,对照组是3个疗程FEC序贯6个疗程紫杉+铂类,两组均为9个疗程全程双靶。同样入组62%、65% N+,30% T3/T4的患者,即便肿瘤负荷较高,9个疗程全程双靶,pCR率仍可高达67% 、68%。所以提示,HER2+仰赖的是HER2信号通路,当采用足够好的抗HER2治疗,是否必须用蒽环已经没那么重要。2020年ASCO公布TRAIN-2三年随访数据,两组3y EFS在93、94%,表现优异。所以临床实践中,推选紫杉联合铂类联合曲妥珠单抗联合帕妥珠单抗作为HER2阳性患者的初选治疗策略。
普遍认为,新辅助治疗目的是降期手术、降期保乳、降期保腋窝,或者决定体内药敏试验,具体看新辅助治疗后肿瘤退缩情况。但如果仅以体内药敏试验作为新辅助治疗目的,至少得有很好的治疗策略。根据肿瘤退缩情况,后续如何抉择新辅助/辅助治疗策略。辅助化疗是一个“全盲“的化疗模式,无法获得药敏信息(同样的方案可能会得到不确定的疗效);传统新辅助化疗是一个“半盲“的化疗模式,药敏信息获得太晚(全程既定新辅方案,pCR预后相对较好,non-pCR可强化辅助);疗效引导的新辅助化疗,强调基于早期疗效评估(如果敏感给予足量敏感治疗,豁免不必要毒性,如果早期判断耐药则尽早局部治疗干预,更换全身治疗方案),真正利用好药敏信息。所以临床实践中需通过早期疗效来判断后续治疗结果。
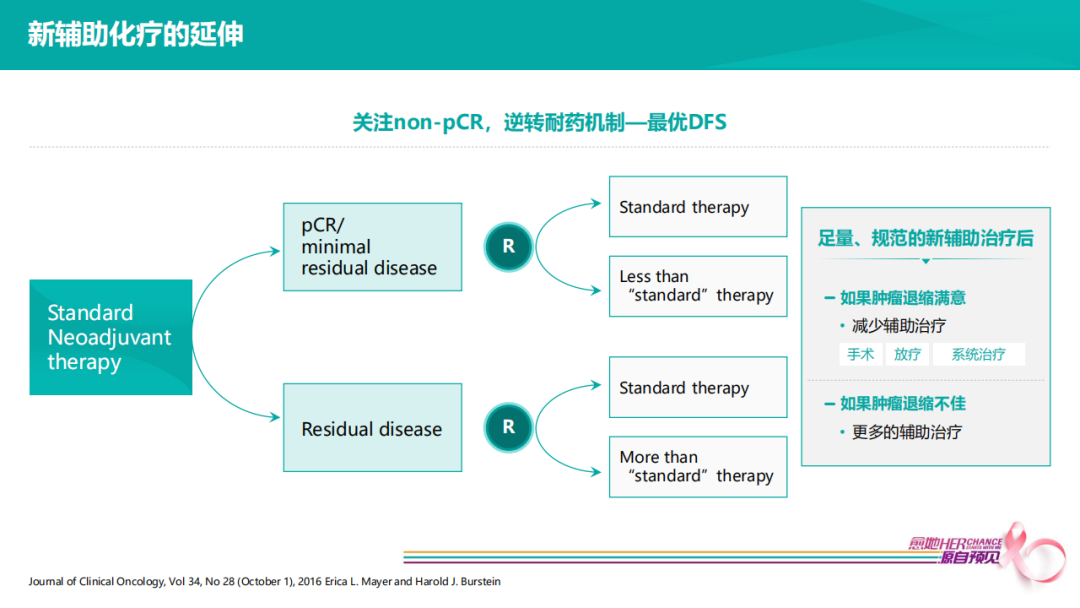
按照以上流程图将患者进行新辅助治疗,达到pCR患者预后很好,可尝试降阶梯治疗,non-pCR患者肿瘤退缩较差,可尝试进行辅助升阶梯治疗,但要获得最优DFS,有三个关键因素。
第一,完成足量、规范新辅助治疗后,才能在选择手术时,根据pCR/non-pCR选择升/降阶梯。例如,HER2+4个疗程EC,non-pCR时选择T-DM1辅助强化,并不符合当前循证医学证据;
第二,HER2+患者,即便全程双靶治疗达到pCR,仍有复发可能,所以在没有足够证据表明pCR患者可以选择降阶梯治疗时,当前对降阶梯仍需持谨慎观点,当患者达到pCR应乘胜追击完成后续足疗程双靶治疗。
第三,对于残留肿瘤,需通过全疗程筛选之后,non-pCR患者才能进行辅助强化。
早期如何判断疗效,如果早期疗效判断出不同结果,临床实践中如何优化后续治疗,值得进一步探索。

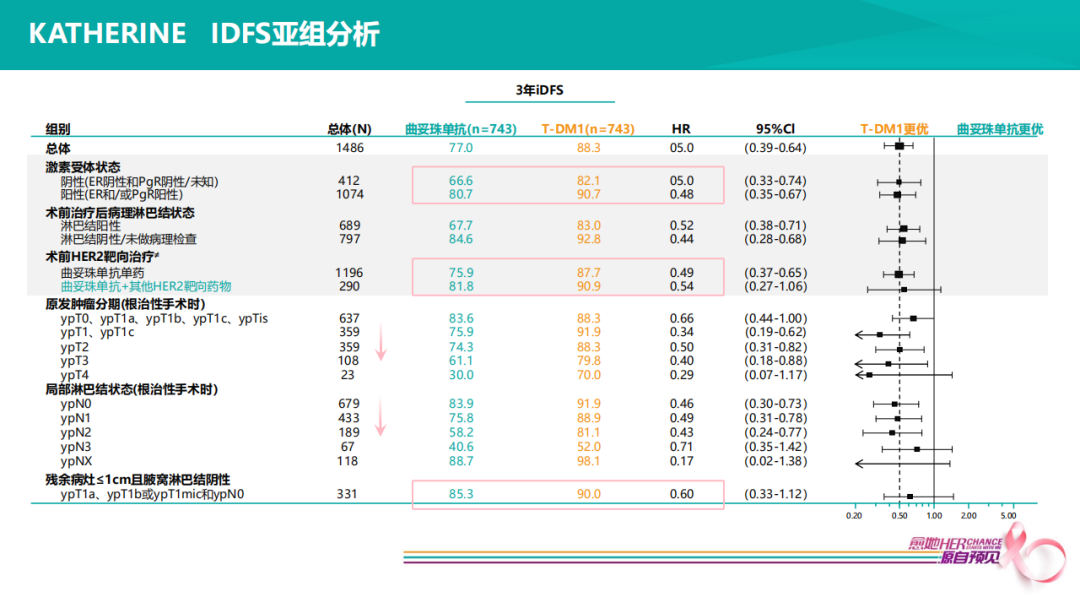
KATHERINE研究表明,HER2+患者选择6个疗程新辅治疗后,至少9周紫杉醇或9周抗HER2治疗后non-pCR患者,使用14个周期的T-DM1对比14个周期的曲妥珠单抗,iDFS降低50%,non-pCR患者,三年预后仍可控制在88%的高位,非常了不起的一个循证医学证据。
KATHERINE iDFS亚组分析显示,在术前HER2靶向治疗亚组,曲妥珠单抗组,双靶20% non-pCR患者,预后81.8%,单靶75.9%,T-DM1组,分别是90.9%和87.7%,提示双靶在新辅助阶段,不仅可以提高pCR率,也使得pCR和non-pCR的自然预后均得以改善。在残余病灶亚组,肿瘤残留越大,复发风险越高,预后越差,但似乎T-DM1逆转能力变得更强,HR值越好,即便肿瘤残留只有几毫米、N-、HER2+患者,通常认为选择好的新辅助治疗之后,4-5㎜ N-的残留已是这类患者中预后非常好的人群,T-DM1仍可降低复发风险40%(HR=0.60)。
1、 新辅阶段如有残留,说明残留肿瘤细胞对新辅助治疗所采用方案耐药。
2、CREATE-X研究,卡培他滨对TNBC患者(HR:0.58);KATHERINE研究,T-DM1对于HER2+患者(HR:0.50)。卡培他滨是蒽环、紫杉治疗失败后,二线治疗策略,T-DM1是紫杉联合抗HER2治疗失败后二线治疗首选。Non-pCR提示体内耐药株的存在,需采用没有交叉耐药的方案进行辅助强化,可改善获益。如果可提早预测non-pCR肿瘤状态,那这部分患者没有必要人为延长带瘤时间,可选择行根治性手术,再行辅助强化治疗。
3、在临床实践中T-DM1可作为辅助强化治疗首选策略;如果因经济条件受限无法使用T-DM1,可考虑双靶方案,但T-DM1可以成为二线治疗首选策略,足以说明其逆转耐药能力最强。
4、以上所有方案均可在辅助阶段进行强化,但HR值或许达不到0.50,对于部分肿瘤退缩较好、残留负荷非常少的患者,完全可以期待PEONY临床实验将于2021年公布的5年随访结果,全组患者中,pCR/non-pCR是否双靶同样优于单靶,届时揭晓。Non-pCR肿瘤残留较小的患者,如果双靶比单靶能够获得非常漂亮的HR值,T-DM1或者曲妥珠单抗联合帕妥珠单抗都可作为辅助强化的可选治疗策略。
1、 有一定肿瘤负荷(T2N1及以上),或者有降阶梯、保乳、保腋窝需求的HER2阳性eBC患者,优选新辅助治疗,并选择PCHP为初选方案。
2、 根据早期疗效评估,有效患者应完成足疗程的PCHP方案,最终达到pCR,辅助PH维持一年全程治疗;non-pCR患者,辅助T-DM1强化治疗。
3、 如果患者疗效不佳,推荐尽早手术,此时采用两个疗程PCHP之后完成手术,辅助阶段补足4个疗程EC,随后根据KRISTINE研究方案,用帕妥珠单抗+T-DM1进行全程辅助强化治疗。
李俊杰教授精彩的报告之后,中山大学孙逸仙纪念医院刘强教授主持了以“缩瘤和治愈”为主题的超级访问,深圳大学第一附属医院王先明教授、广东省人民医院王坤教授、中山大学附属第一医院林颖教授、中山大学附属肿瘤医院唐军教授、云南省肿瘤医院陈德滇教授、华中科技大学附属同济医院李兴睿教授及辽宁省肿瘤医院张强教授参与了讨论,专家们对早期HER2阳性乳腺癌的新辅助治疗策略分别发表了自己的观点:
刘强教授:结合李俊杰教授的演讲,结合您的临床实践,对HER2+新辅助治疗的经验或问题谈一下个人观点?
陈德滇教授:对于比较高危的患者(病期较晚、肿块较大、腋结阳性、有淋巴结转移、并且有保乳意愿),在新辅中阶段使用双靶,与单靶相比,疗效更为显著。实际临床中有很多医生认为,单靶+化疗疗效较好的情况下,可能不会选择使用双靶,通过李俊杰教授的演讲,也进一步说明了这部分患者用双靶加化疗的方案确实会有更好的生存获益。
刘强教授:在目前乳腺癌分子分型中,HER2+乳腺癌pCR率最高(可达到50%-70%以上),如何去优化治疗,请谈一下您的看法?
李兴睿教授:?外科医生普遍关注乳腺癌新辅助治疗与更加完善的手术。关于在新辅阶段如何用早期方法预测患者是否能达到pCR/non-pCR,个人也有一些设想,比如借鉴新辅助内分泌阶段对肿瘤进行活检,第2-4次活检之后,来判断新辅助靶向治疗疗效如何,或者能否在初次病理后,对乳腺癌HER2+表达强度以及抑制性做出相应病理学分析,是否有助于预测患者能否达到pCR,期望能听到更多国内专家相关研究。现有阶段,HER2+新辅助使用双靶治疗已经能达到很好的pCR率,如果non-pCR,后续治疗中可以选择双靶,或者TDM-1,或者使用一些低毒性可持续使用的化疗药物联合双靶,期待在未来随着领域的学术发展,对non-pCR的患者,在辅助强化治疗中可以有更多方案选择。
林颖教授:?第一,PEONY研究提示,一部分曲妥珠单抗单靶治疗后,没有达到pCR的患者,后续辅助用双靶治疗;第二,新辅助治疗是否可以去蒽环,根据Aphinity亚组分析,蒽环/去蒽环的化疗方案与搭配,生存率相当,TRAIN-2研究在ASCO所报道的结果也是相似的,个人认为,TCbHP和EC-THP,无论是pCR率还是生存数据,疗效相当;第三,如果TCbHP疗效不佳,选择手术,辅助补足EC方案,后续TDM-1,这是一个个体化选择。假如TCbHP只用了2-3个疗程,还是可手术状态,肿瘤负荷不是特别大,是否可以考虑在新辅阶段加用EC,甚至对于较年轻的患者,如果心脏安全性好,也可考虑同时用上双靶,观察疗效,辅助中更加明确是否耐药。
?
刘强教授:林颖教授刚刚谈到了一个非常好的点,其实做新辅助目的,就是希望看到个体化的患者对于治疗方案的疗效,从而进行个体化的辅助方案设计或整体方案调整,更有针对性地选择,这是新辅助治疗的的魅力所在。有请唐军教授谈一下自己的观点。
唐军教授:随着HER2+乳腺癌治疗从单靶时代进入双靶时代,疗效越来越好,新辅助pCR率也在逐渐增加,当我们有越来越多新药选择的时候,如何更好地缩瘤最终走向治愈,值得考量。曲妥珠单抗4个典型临床试验单靶辅助治疗10年生存率几乎到70%以上,如今双靶在新辅助治疗中可以很快缩瘤并明显提高pCR率。如何精准选择更合适的患者使用双靶,如何通过新辅助治疗更精准的预判疗效,期待未来更多临床证据。
刘强教授:2020年ASCO报道了一项王坤教授牵头的HER2+新辅助的临床研究,请结合您的临床研究谈一谈自己的看法。
王坤教授:今年ASCO上报道的Newcash研究是AC-TH和TCH头对头的比较,AC-TH的pCR率是38%,而早期加上曲妥珠单抗之后,TCH方案pCR是56%,验证了早期用抗HER2治疗有助于控制肿瘤,提高pCR,所以我坚定支持在新辅助阶段用TCHP。今年ASCO也更新了TCHP数据,在新辅阶段出现PD的概率是0%,而TDM-1联合帕妥珠单抗还有5.7%的PD,假如之前没有用曲妥珠单抗治疗,AC-TH有1/4的病人容易出现进展。从外科医生角度,早点用妥妥双靶,早点给予更强方案,对缩瘤、手术和生存都有帮助,所以我坚定地认为TCHP是目前HER2+新辅助治疗首选方案。
?
刘强教授:?TCH或者TCHP方案的应用越来越广泛,3年EFS也较高,但对于那些反应欠佳,总体还没有达到pCR,哪怕是大PR的患者,您会不会选择追加EC或者AC?
王坤教授:对于这样的患者假如是PR状态,建议做完6个周期新辅助治疗,再手术,根据术后病理判断pCR/non-pCR,如果是non-pCR后续强化用TDM-1。
王先明教授:新辅助治疗中缩瘤速度值得关注,新辅前两个周期是否有效很重要,可以给患者带来信心,给医生带来希望。分子分型时代,HER2+乳腺癌主要选择HER2治疗,在我的临床实践中,有关HER2+新辅助治疗中,先后用过TCH、TCHL、TCHP方案,pCR率不断提高,疗效越来越好。帕妥珠单抗的出现双靶的联合对于HER2+乳腺癌的新辅助治疗是必不可少的。
张强教授:?第一,新辅助治疗首先应选择合适人群,治疗目的除了手术需求,更多是筛选出non-pCR患者,选择个体化治疗方案,改善预后。对于pCR患者,正如李俊杰教授所提到的,如果在早期评估中能预测患者是否可以达到pCR状态,无论是否完成足疗程,是否选择手术,我认为都是可以的;第二,方案优选,在新辅治疗中我认可靶向治疗先行,但是否舍弃蒽环,目前还缺乏依据;第三,对于TCbHP方案,在疗效不佳的情况下,手术后应补充蒽环类药物。
复旦大学附属肿瘤医院 副主任医师、博士
美国麻省总院癌症中心clinical Research Fellow
上海抗癌协会乳腺癌专业委员会青年委员
JCO中文版青年编委
参与多项国际国内多中心临床试验
发表SCI论文十余篇
中山大学孙逸仙纪念医院 普外科主任、乳腺肿瘤中心主任
乳腺外科主任、主任医师、博士生导师
中南大学湘雅医学院七年制临床医学专业毕业
新加坡国立大学医学院外科博士
哈佛大学Dana Farber癌症中心讲师
ESO-ESMO年轻乳腺癌国际共识专家组成员
日本京都乳腺癌共识专家组成员
亚洲乳腺癌协作组成员
中国肿瘤临床学会乳腺癌专业委员会常务委员
中国抗癌协会肿瘤分子医学专业委员会常务委员
中国抗癌协会乳腺癌专业委员会委员
广东省医学会外科分会乳腺疾病学组组长





 京公网安备 11010502033352号
京公网安备 11010502033352号